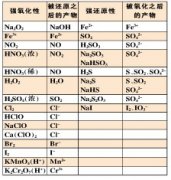
(一)概述
1.硝酸是强酸,具有酸的通性;
2.浓、稀硝酸都有强的氧化性,浓度越大,氧化性越强。
3.硝酸属于挥发性酸,浓度越大,挥发性越强(98%以上为发烟硝酸),
4.硝酸不太稳定,光照或受热时会分解(长期放置时变黄色的原因?保存注意事项?棕色瓶冷暗处);
5.硝酸有强烈的腐蚀性,不但腐蚀肌肤,也腐蚀橡胶等,
6。工业制硝酸用氨的催化氧化法(三步反应?)。
7.硝酸可与大多数金属反应,通常生成硝酸盐。
8.浓硝酸可氧化硫、磷、碳等非金属成高价的酸或相应的氧化物,本身还原为二氧化氮。
9.硝酸(混以浓硫酸)与苯的硝化反应
硝酸(混以浓硫酸)与甲苯的硝化反应(制TNT)
10.硝酸与乙醇的酯化反应。
与甘油的酯化反应
(二)硝酸与金属反应的“特殊性”及规律
1.浓硝酸与铁、铝的钝化现象(原因及应用:钝化。常温可以用铝罐车或铁罐车运硝酸)(表现了浓硝酸的什么性质?)
2.浓、稀硝酸与活泼金属反应都不生成氢气(原因?)
3.浓、稀硝酸能与铜、银等不活泼金属反应(表现了硝酸的什么性质?试管中粘附的铜或银用什么来洗?)
4.与金属反应时硝酸的主要还原产物:
(1)、与铜、银等不活泼金属反应,浓硝酸生成NO2,而稀硝酸生成NO
(2)、与锌、镁等活泼金属反应,还原产物比较复杂,其价态随金属活泼性增强和酸的浓度降低而降低,最低可得NH4+。
(3)、浓、稀硝酸与金属反应中的作用:表现出——酸性、强氧化性(注意:定量计算中应用)
5.稀硝酸与铁反应,如果硝酸过量,生成三价铁盐,如果铁过量,生成二价铁盐(在硝酸与铁的摩尔比的不同溶液中铁元素存在的形式不同)。
当前位置:主页 > 考试 > 学历类 > 高考 > 各科备考 > 高考化学备考 > >
高考化学知识点:有关硝酸考点整理
来源::未知 | 作者:棋牌游戏大全_棋牌游戏下载_官网推荐最火爆棋牌游戏平台* | 本文已影响 人
- 上一篇:高三化学知识点 热化学方程式
- 下一篇:高考化学复习指导 历届高考题必看
随机阅读
- [高考化学备考] 怎样掌握高中化学学习方法
- [高考化学备考] 化学解决计算题失分的步骤
- [高考化学备考] 高考化学知识点:常见的氧
- [高考化学备考] 高中化学学习中总结的四个
- [高考化学备考] 高三化学知识点 化学反应
- [高考化学备考] 高考化学复习指导:轻重分
- [高考化学备考] 高考化学知识点:带颜色的
- [高考化学备考] 怎样做化学元素推断题
- [高考化学备考] 理综化学大题高分技巧
- [高考化学备考] 高中化学离子方程式判断
- [高考化学备考] 高中化学方程式总结
- [高考化学备考] 高考化学学习防范:化学知
- [高考化学备考] 高中化学易错知识点
- [高考化学备考] 高考化学复习方法: 改变
- [高考化学备考] 高三化学知识点 电解质
- [高考化学备考] 化学教学中渗透绿色化学教